Calcular la Presión Osmótica
|
La presión osmótica de una disolución diluida, obedece una relación de la misma forma que la de la ley de gas ideal:  En los textos de química, se expresa normalmente en términos de la molaridad de la solución y se denota con el símbolo π. 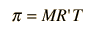 En esta relaciones, R = 8,3145 J/ºK mol, es la constante de gas normal y R'= 0,0821 L atm/ºK mol, es la constante de gas expresada en términos de litros y atmósferas. |

Tenga en cuenta que en el cálculo de la izquierda, la presión osmótica se atribuye a la solución, mientras que la definición de la presión osmótica que se ha utilizado aquí trata la presión osmótica positiva, como la relación entre la densidad de energía relativa del disolvente puro y la disolución. Puesto que los textos de biología y química más actuales, atribuyen la alta presión osmótica a la disolución y no al disolvente puro en relación con la solución, voy a tener que ceder y redefinir la presión osmótica, para ser compatibles con los usos comunes. Desde el punto de vista físico, parece un paso atrás. |
| Energía Térmica |
Conceptos sobre Teoría Cinética
Aplicaciones sobre Teoría Cinética
Conceptos de Flúidos
| HyperPhysics*****Termodinámica | M Olmo R Nave |