Principio de Exclusión de Pauli
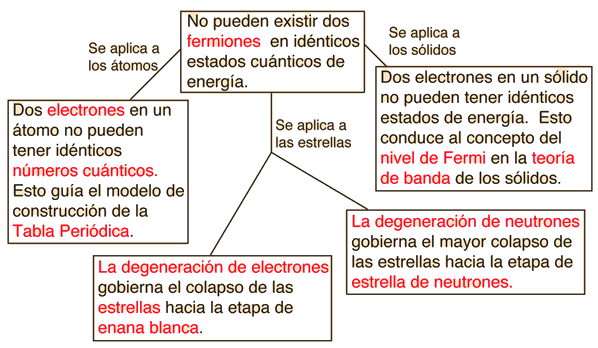
Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero (fermiones). No se aplica a partículas de espín entero (bosones).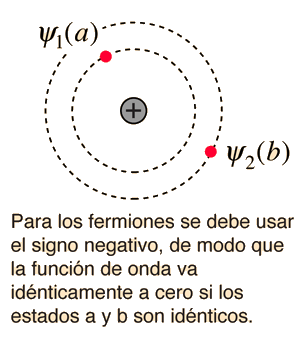 |
La naturaleza del principio de exclusión de Pauli se puede ilustrar mediante la suposición de que los electrones 1 y 2 están en los estados a y b respectivamente. La función de onda para el sistema de dos electrones sería  pero esta función de onda no es aceptable porque los electrones son idénticos e indistinguibles. Para tener en cuenta esto, se debe utilizar una combinación lineal de las dos posibilidades, ya que no es posible determinar cual electrón está en cual estado. |
La función de onda para el estado, en el que son ocupados por los electrones los dos estados "a" y "b", se pueden escribir

El principio de exclusión de Pauli es parte de una de nuestras observaciones más básicos de la naturaleza: las partículas de espín semientero, debe tener funciones de onda antisimétricas, y las partículas de espín entero debe tener funciones de onda simétricas. El signo menos en la relación anterior obliga a la función de onda a desaparecer, si ambos estados son "a" o "b", lo que implica que es imposible que dos electrones ocupen el mismo estado.
Aplicaciones
Conceptos de Estructura Atómica
| HyperPhysics*****Física Cuántica | M Olmo R Nave |