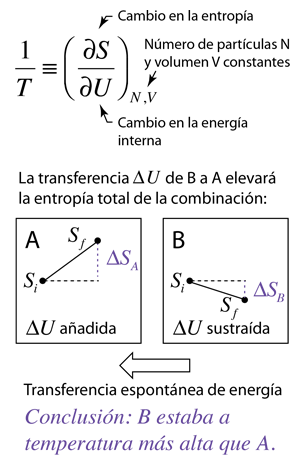¿Qué es la Temperatura?
 La Ley Cero de la Termodinámica |
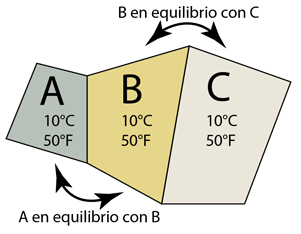
Una aproximación a la definición de temperatura es considerar tres objetos, por ejemplo, bloques de cobre, hierro y aluminio que están en contacto de manera que lleguen al equilibrio térmico. Por equilibrio queremos decir que ya no están transfiriendo ninguna energía neta entre sí. Luego diríamos que están a la misma temperatura, y diríamos que la temperatura es una propiedad de estos objetos, lo que implica que ya no transferirán energía neta entre sí. Podríamos decir que A está a la misma temperatura que C aunque no estén en contacto entre sí. Este escenario se denomina "ley cero de la termodinámica", ya que este entendimiento precede lógicamente a las ideas contenidas en las importantes primera y segunda Leyes de la Termodinámica. |
 Temperatura Cinética 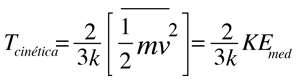
Ideas para reflexionar sobre:
|
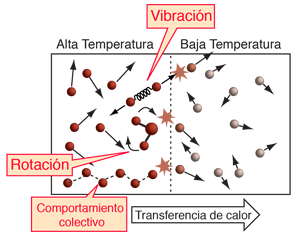
Una idea importante relacionada con la temperatura es el hecho de que en una colisión entre una molécula con alta energía cinética y una con baja energía cinética se transferirá energía a la molécula de menor energía cinética. Parte de la idea de la temperatura es que, para dos colecciones del mismo tipo de moléculas que están en contacto entre sí, la colección con mayor energía cinética promedio transferirá energía a la colección con energía cinética promedio más baja. Diríamos que la colección con mayor energía cinética tiene una temperatura más alta, y que la transferencia de energía neta será desde la colección de temperatura más alta a la colección de temperatura más baja, y no al revés. Claramente, la temperatura tiene que ver con la energía cinética de las moléculas, y si las moléculas actúan como masas puntuales independientes, entonces podríamos definir la temperatura en términos de la energía cinética de traslación media de las moléculas, la llamada "temperatura cinética". La energía cinética promedio de las moléculas de un objeto es una parte importante del concepto de temperatura y proporciona una intuición útil sobre qué es la temperatura. Si toda la materia consistiera simplemente en masas de puntos que se movieran de forma independiente y que solo experimentaran colisiones elásticas entre sí, sería una imagen adecuada de la temperatura. |
Los movimientos internos o coordinados de las moléculas complican la imagen de la temperatura. |
Las moléculas para materiales distintos de los gases nobles monoatómicos como el helio tienen posibilidad de otra energía distinta de la energía cinética de traslación de masas puntuales. Las moléculas pueden tener energía cinética de rotación y traslación y las moléculas en sólidos periódicos pueden tener modos colectivos de movimiento que tienen energía. Esto complica la idea de la temperatura porque afectan a las condiciones en las cuales la energía sería transferida de una colección de moléculas a otra, y queremos aferrarnos a la idea de que si la energía se transfiere espontáneamente de A a B, entonces A está en un nivel de temperatura más alto que B. |
Definición de la temperatura en términos de entropía. |
Muchos de los argumentos más fundamentales en física son los que tienen que ver con la multiplicidad. Si hay más formas de lograr un estado dado de un sistema de partículas, entonces otros estados pasarán espontáneamente a ese estado a lo largo del tiempo si la transición es consistente con la conservación de la energía. La multiplicidad de un sistema de partículas se expresa en términos de su entropía. Los sistemas avanzarán espontáneamente hacia estados con mayor entropía (2ª ley de la termodinámica). ¿Pero qué tiene eso que ver con la temperatura? Resulta que si se tiene dos sistemas A y B que están acoplados térmicamente entre sí, y se realiza un cambio de energía interna ΔU en cada uno de ellos, entonces si A experimenta un cambio mayor en la entropía S que B, entonces A está a menor temperatura y la energía se transferirá espontáneamente de B a A. ¡Esto es mucho menos intuitivo que las moléculas de alta velocidad que golpean las moléculas de baja velocidad y transfieren energía a ellas!. Pero con la variedad de formas de energía y modos colectivos en los sistemas, resulta ser un enfoque más confiable para la temperatura. Véase los ejemplos donde este enfoque con el gas ideal y el sólido de Einstein nos lleva de vuelta a declaraciones de energía cinética más intuitivas. |
Bajo condiciones donde la temperatura cinética como derivada de la teoría cinética proporciona una precisión razonable, percibimos la temperatura como la energía cinética de traslación promedio asociada con el movimiento desordenado de los átomos y las moléculas. Eso hace que sea intuitivo que el flujo de calor sea desde una región de alta temperatura hacia una región de temperatura más baja, ya que las moléculas de energía más alta golpean a las moléculas de energía más baja y transfieren energía a ellas. La temperatura no es directamente proporcional a la energía interna, ya que la temperatura mide solo la parte de energía cinética de la energía interna, por lo que dos objetos con la misma temperatura en general no tienen la misma energía interna (véase el ejemplo de agua y metal). Las temperaturas se miden en una de las tres escalas de temperatura estándares (grados Celsius, Kelvin y Fahrenheit).
| Supongamos que estamos tratando con dos objetos de igual masa a temperaturas ordinarias y podemos suponer que la temperatura cinética proporciona una descripción razonable de su comportamiento. Si los dos objetos están a la misma temperatura, entonces diríamos que sus energías cinéticas de traslación promedio son las mismas. Eso no implica que sus energías internas totales sean iguales, porque las energías potenciales asociadas con las fuerzas intermoleculares pueden ser muy diferentes. |
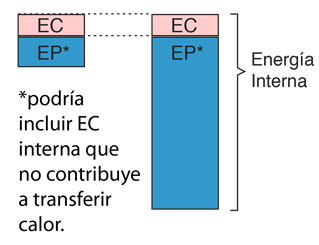 |
Incluso si hay energías cinéticas internas distintas de la energia cinética traslacional, podría ser que la transferencia de calor sea principalmente por transferencia colisional. En tales casos, esta imagen puede ayudar a comprender que solo una parte de la energía interna total de los objetos está involucrada en las condiciones para el equilibrio térmico
| Escalas de Temperaturas |
| Vista de la Temperatura Más Generalizada |
Conceptos de Temperatura
Referencia:
Schroeder
Cap. 3
| HyperPhysics*****Termodinámica | M Olmo R Nave |