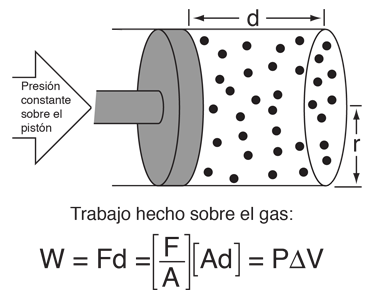
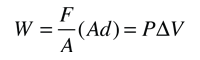Ejemplo de Calor y Trabajo

Este ejemplo de intercambio entre calor y trabajo como agentes que añaden energía a un sistema, nos puede ayudar aclarando algunos conceptos erróneos sobre el calor. Encontré la idea en un pequeño artículo de Mark Zemansky titulado "Uso y mal uso de la palabra 'calor' en la enseñanza de la Física". La idea clave de este ejemplo es que, si se nos presenta un gas con una temperatura alta, no podemos decir si alcanzó esa temperatura alta por calentamiento, por ejercer trabajo sobre él, o una combinación de los dos.
En la descripción de la energía que tiene un objeto a alta temperatura, no es correcto el uso de la palabra calor para decir que el objeto "posee calor" - es mejor decir que el objeto posee energía interna, como resultado de su movimiento molecular. Es mejor reservar la palabra calor para describir el proceso de transferencia de energía, desde un objeto a alta temperatura hacia otro a mas baja temperatura. Seguramente podemos tomar un objeto con baja energía interna y elevarla a una energía interna mas alta por medio de su calentamiento. Pero tambien podemos aumentar su energía interna realizando trabajo sobre él, y como la energía interna de un objeto a alta temperatura reside en el movimiento aleatorio de sus moléculas, no podemos decir que mecanismo se usó para proporcionarle esa energía.
Para advertir a profesores y estudiantes sobre los peligros del mal uso de la palabra "calor", Mark Zemansky aconseja reflexionar sobre la canción:
|
"La enseñanza de física térmica
Es tan facil como una canción:
Crees que la haces mas sencilla
Cuando la haces un poco mal."
| Declaración de Zemanzky
Él no usa el término "calor de un cuerpo", o dice "este cuerpo tiene el doble de calor que ese otro". También objeta que se use el vago término de "energía térmica", y el uso de la palabra calor como verbo, porque están alimentadas de ideas falsas, aunque resulta difícil evitar esos términos. Él aconseja la introducción y uso del concepto de energía interna, tan pronto como sea posible.
|
Zemansky apunta que la primera ley de la Termodinámica es una relación a aclarar. La primera ley identifica a ambos el calor y el trabajo, como métodos de transferencia de energía, que pueden llevar a cabo un cambio en la energía interna de un sistema. Despues de ello, ninguna de las palabras calor y trabajo tienen utilidad alguna en la descripción del estado final del sistema -solo podemos hablar de la energía interna del sistema-.
|
Índice
Conceptos de Energía Interna
Referencia
Zemansky |