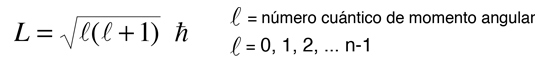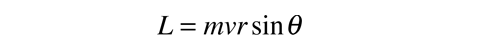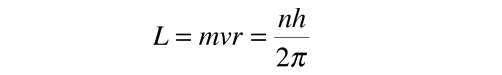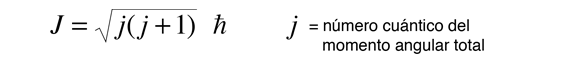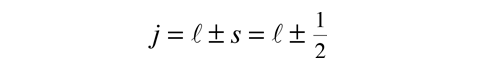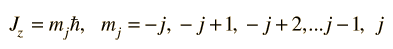Momentum Angular Cuantizado
En el proceso de resolución de la ecuación de Schrödinger para el átomo de hidrógeno, se encuentra que el momento angular orbital está cuantizado de acuerdo con la relación:
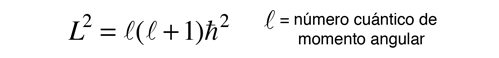
Es una característica del momento angular en la mecánica cuántica, que la magnitud del momento angular en términos del número cuántico orbital, sea de la forma
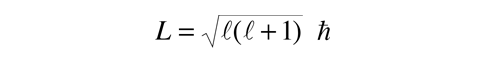
y que el componente z del momento angular en términos del número cuántico magnético, tome la forma

Esta fórmula general se aplica al momento angular orbital, al momento angular del espín, y al momento angular total de un sistema atómico. La relación entre la magnitud del momento angular, y su proyección a lo largo de cualquier dirección en el espacio, es visualizada a menudo en términos de un modelo vectorial.
| HyperPhysics*****Física Cuántica | M Olmo R Nave |